
君も化学者! 水を電気分解してみよう!
実験は必ず大人と一緒に行ってください。実験するときは,保護めがねを着用してください。
準備するもの
- 硫酸ナトリウム
- 薬さじ(大)
- ガラス棒
- イオン交換水
- BTB溶液
- ビーカー100 mL
- 角形の醤油さし*2個
- 金属製のゼムクリップ2個
- セロハンテープ
- 駒込ピペット5 mL
- 9 Vの電池
*柔らかい材質のもの
実験方法1
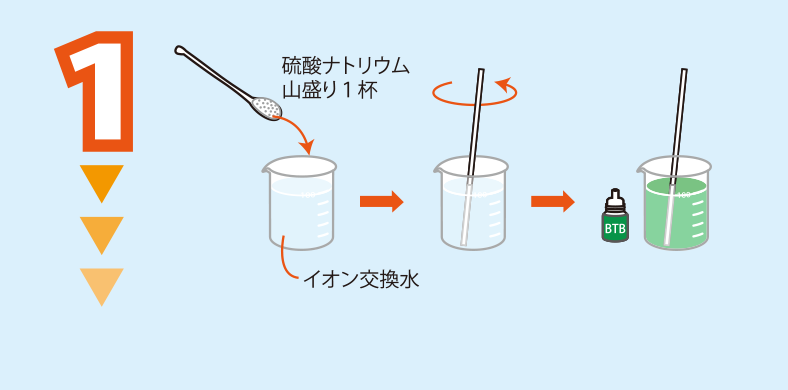
硫酸ナトリウム水溶液をつくり,BTB溶液を加え水溶液の色を緑にする
実験方法2
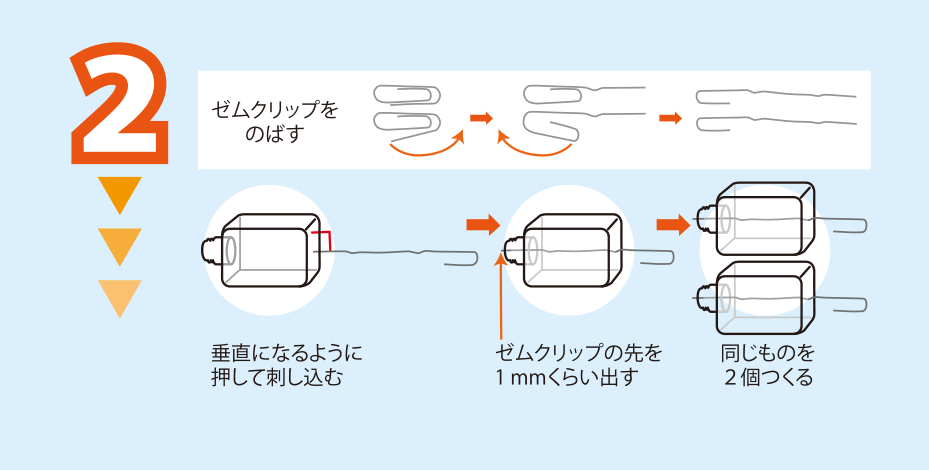
醤油さしにのばしたゼムクリップを刺し込む
<注意>ゼムクリップを手に刺さないように注意すること
<アドバイス>ゼムクリップは,醤油さしに一度刺したら抜かないこと
実験方法3
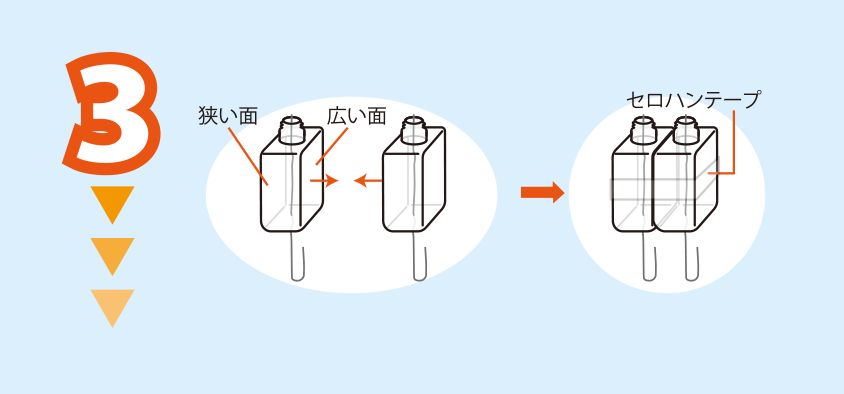
醤油さしの広い面を合わせて,セロハンテープで貼り合わせる
実験方法4
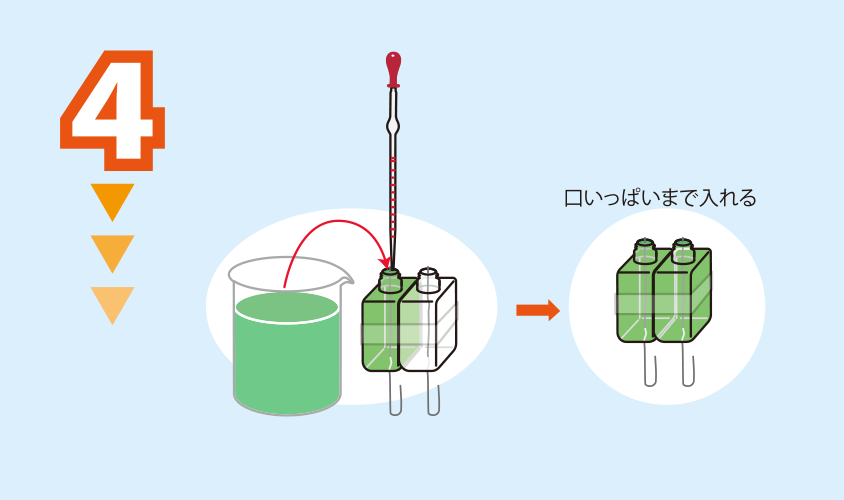
実験方法1の水溶液を,醤油さしの口いっぱいまで,駒込ピペットを使って入れる
実験方法5
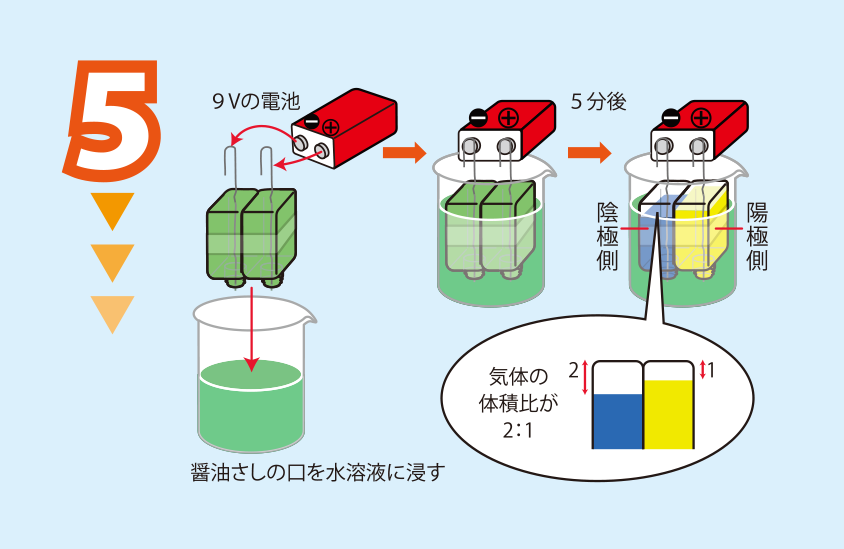
残っている水溶液に醤油さしの口を浸した状態で,9 Vの電池につなぎ,電気分解する
<注意>ゼムクリップどうしが接触しないようにする。接触していると,ショートしてゼムクリップが熱くなる
実験の解説
水H2Oに硫酸ナトリウムを溶かして電気を流すと,水が分解され,陰極では水素H2が,陽極では酸素O2が発生します。この反応を水の電気分解といいます。化学反応式で表すと2H2O → 2H2 + O2となります。このとき,発生したH2とO2の体積の比は,この化学反応式からわかるように,2:1となります。
硫酸ナトリウム水溶液にBTB溶液を加えても,水溶液の色は緑のままで,この水溶液は中世です。ところが電気分解を始めると,陰極側では青(アルカリ性)に,そして,陽極側では黄(酸性)に変化します。このことから,陰極ではアルカリ性のもとであるOH-が,陽極では酸性のもとであるH+が生成したことがわかります。陰極,陽極では,それぞれ次のような反応がおこります。この反応式の中のe-は電子を表しています。
陰極:2H2O + 2e- → H2 + 2OH-
陽極:2H2O → O2 + 4H+ + 4e-
化学だいすきクラブニュースレター第45号(2020年7月1日発行)より編集/転載




