
君も化学者! セロハンの穴を通り抜けるのは何!?
実験は必ず大人と一緒に行ってください。実験するときは,保護めがねを着用してください。
準備するもの
- 15 %塩化鉄(III)水溶液
- BTB溶液(点眼瓶に入れておく)
- 1 %硝酸銀水溶液
- 純水
- 300 mLビーカー3個((A),(B),(C))
- 試験管2本
- 駒込ピペット3本
- シート状のセロハン(約70 cm×70 cm程度)*1
- 実験用ホットプレート*2
- 輪ゴム
*1 シート状のセロハンは,インターネットで購入できる。
*2 実験用ホットプレートがない場合は,ガスバーナー,三脚,金網,点火器具で代用できる。
実験方法1
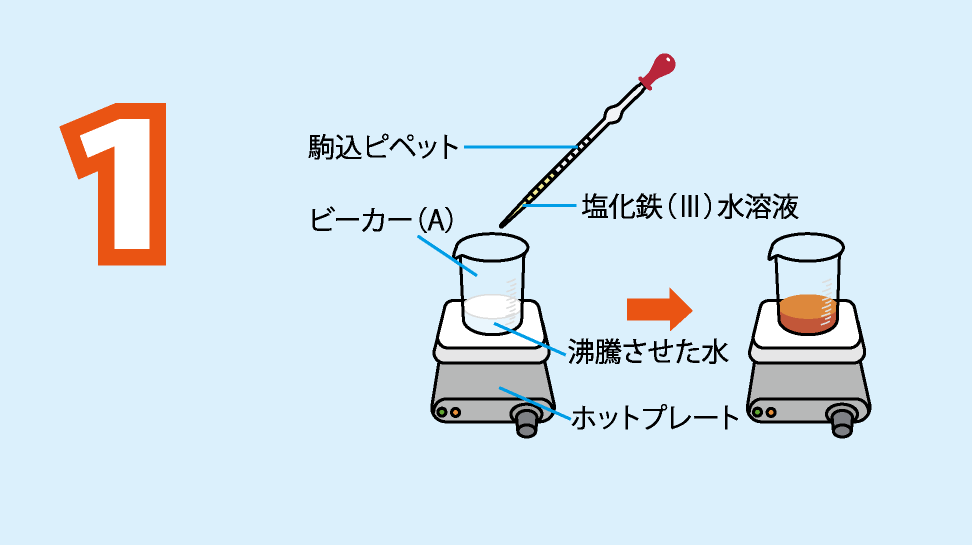
ビーカー(A)に純水を約100 mL入れ,ホットプレート上で加熱する。沸騰したら,駒込ピペットで15 %塩化鉄(III)水溶液を2 mL加え,加熱をやめる
<注意>火傷に注意する
実験方法2
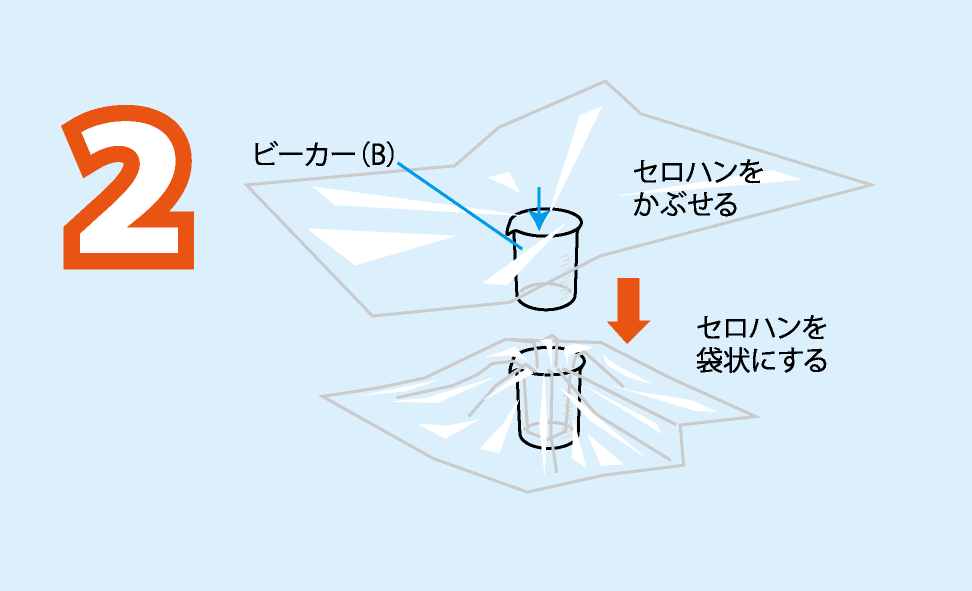
ビーカー(B)にセロハンをかぶせ,ビーカーの中で袋状にする
<注意>セロハンを破らないように,丁寧に行う
実験方法3
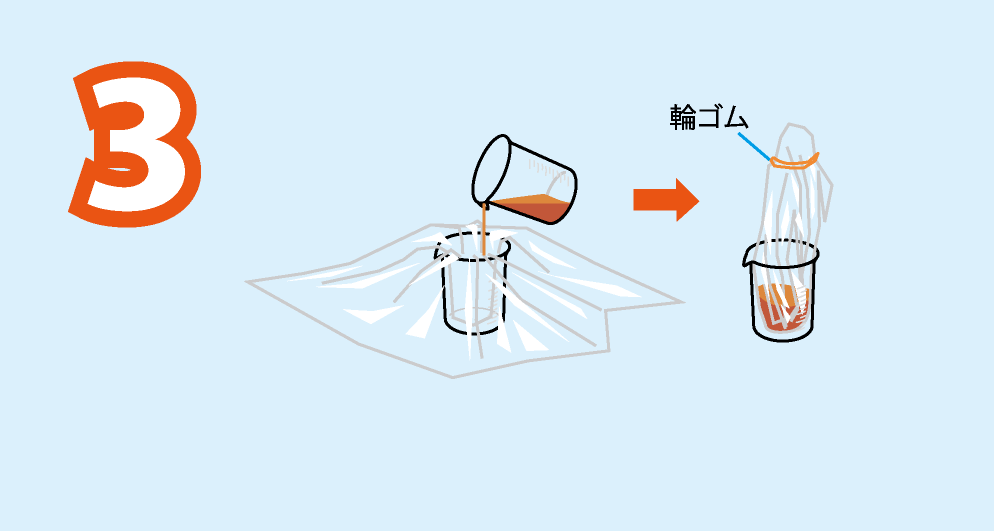
十分に冷めた実験方法1の水溶液をセロハンの袋に移し,セロハンの端を束ねて輪ゴムでしばる
<注意>ここでもセロハンを破らないように,丁寧に行う
実験方法4
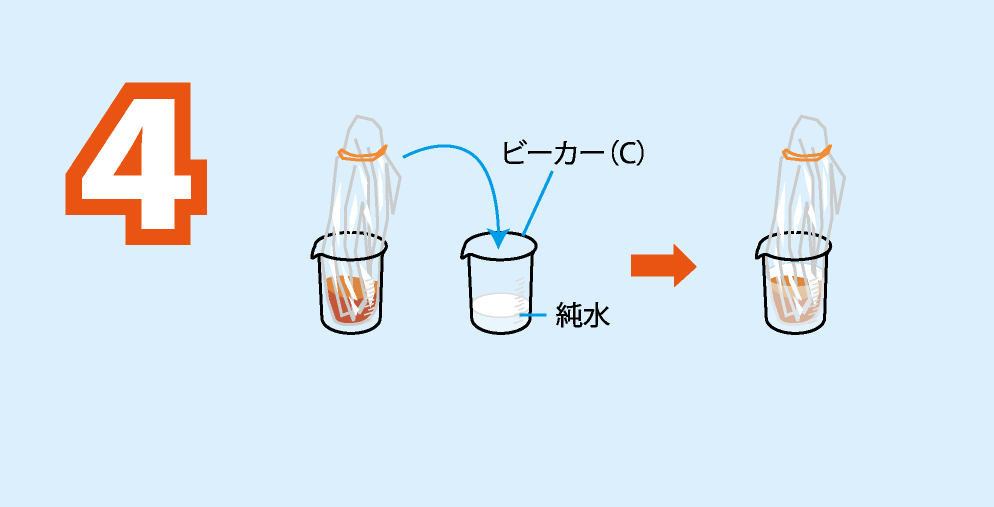
ビーカー(C)に純水を約100 mL入れ,この中に実験方法3のセロハンの袋をゆっくりと沈める
実験方法5
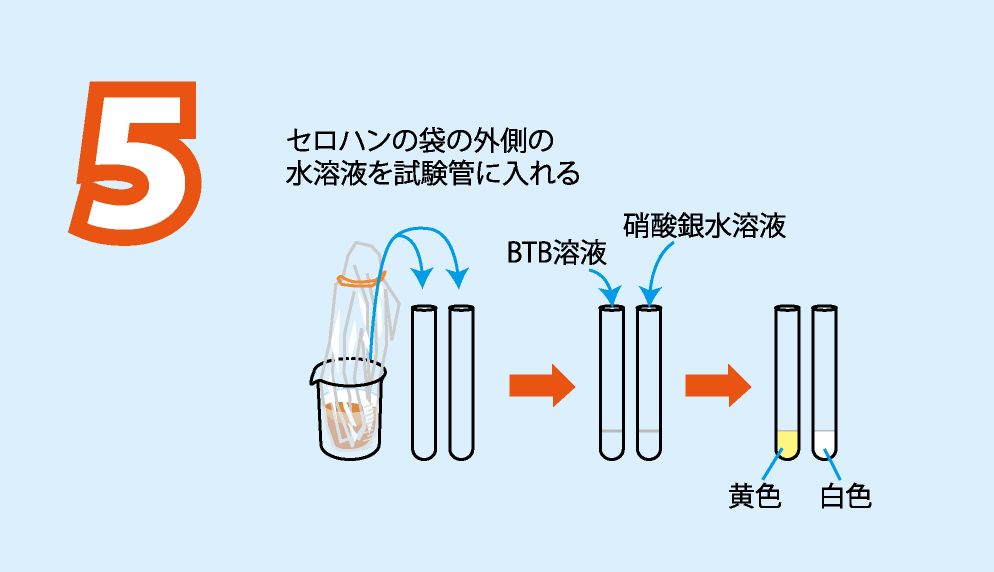
10分ほど放置した後,実験方法4のセロハンの袋の外側の水溶液を駒込ピペットで試験管2本に2 mLずつ入れる。1本目の試験官にはBTB溶液を,2本目の試験官には1 %硝酸銀水溶液を数滴加える
<注意>硝酸銀水溶液を皮膚につけないように注意する(ゴム手袋をするとよい)
実験の解説
塩化鉄(III)FeCl3水溶液を沸騰した水に加えると,次の反応が起こって赤褐色の水酸化鉄(III)Fe(OH)3が生成します(反応式(1))。
FeCl3 + 3H2O → Fe(OH)3 + 3HCl ⋯(1)
このFe(OH)3は水に溶けにくく,複数の分子が集まって大きな粒子を形成し,水溶液中に分散しています。このような粒子をコロイド粒子と言います。一方,塩化水素HClは水溶液中で電離して,水素イオンH+と塩化物イオンCl–になります。セロハンには目に見えないとても小さな穴が開いていて,イオンは通り抜けられますが,コロイド粒子は通り抜けることができません。このため,Fe(OH)3は通り抜けることができず,セロハンの袋の外側の水溶液は無色透明のままです。しかし,H+とCl–は通り抜けられるため,実験方法5のように,セロハンの袋の外側の水溶液に緑色のBTB溶液を滴下すると,酸性の原因であるH+のために溶液の色が黄色に変化します。そして,硝酸銀AgNO3水溶液を加えると,AgNO3中の銀イオンAg+とCl–が反応して,白色の塩化銀AgClが生成します(反応式(2))。生成したAgClは水に溶けにくいため,白く濁ります。AgNO3水溶液は塩素の検出に用いられ,水道水に加えても白く濁ります。
Ag+ + Cl– → AgCl ⋯(2)
※実験後の廃液は,先生の指示にしたがって適切に処理してください。
化学だいすきクラブニュースレター第47号(2021年4月1日発行)より編集/転載




