
君も化学者! 青と赤のきれいな瞳を作ろう!
実験は必ず理科の先生と一緒に行ってください。
実験するときは,保護めがね着用してください。
準備するもの
- 3%食塩水
- 1%ヘキサシアニド鉄(III)酸カリウム水溶液
- フェノールフタレイン溶液
- 100 mLビーカー 1個
- メスシリンダー 1本
- コマゴメピペット 1本
- ガラス棒 1本
- 鉄板*
- 紙やすり
*大きさは問わない。ここでは約1.2 cm×5.0 cmの長方形の鉄板を用いた。
実験方法1
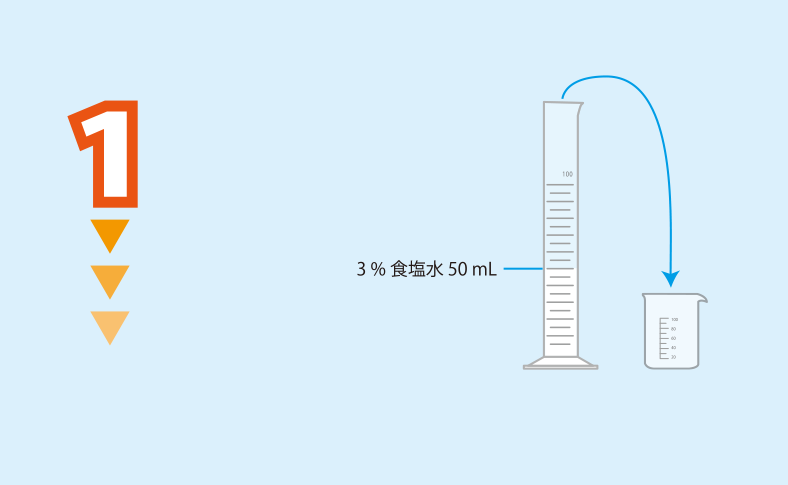
メスシリンダーを用いて3%食塩水を50 mLはかり,100 mLビーカーに入れる。
実験方法2
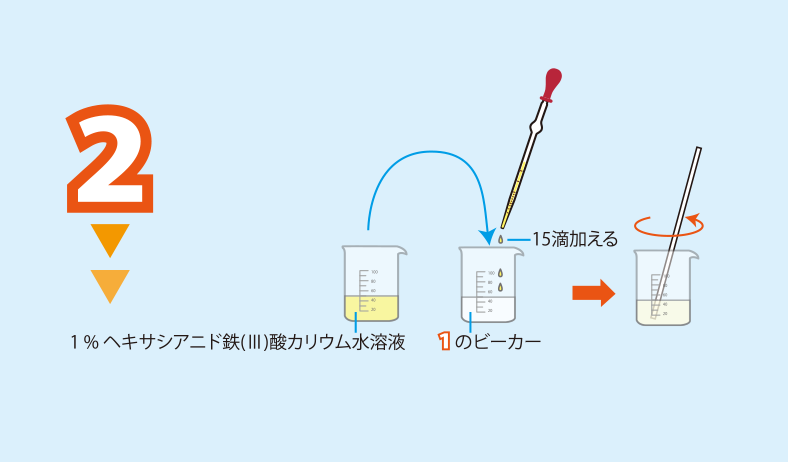
実験方法1のビーカーに駒込ピペットを用いて1%ヘキサシアニド鉄(III)酸カリウム水溶液を15滴加え,ガラス棒で撹拌する。
実験方法3
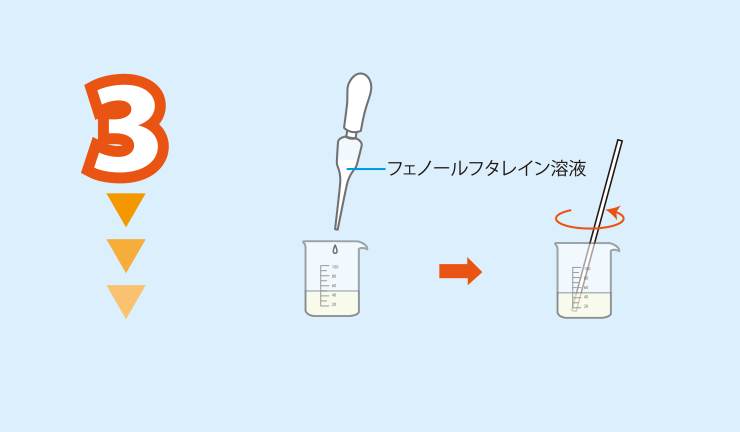
実験方法2のビーカーにフェノールフタレイン溶液を5滴加え,ガラス棒で撹拌する。
実験方法4
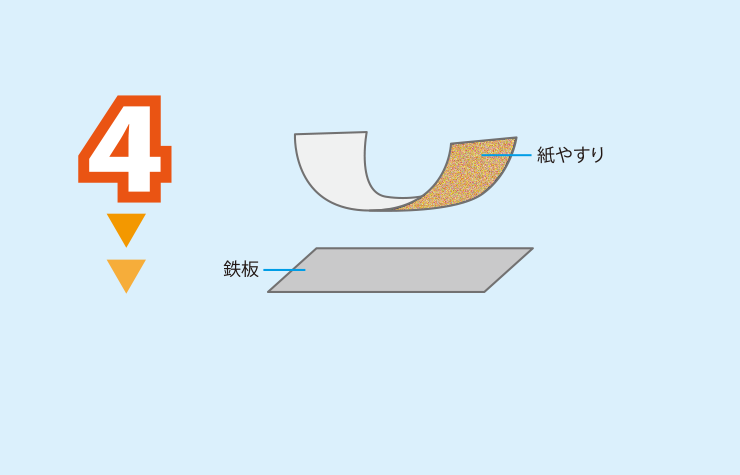
鉄板の表面を紙やすりで磨く(片方の面だけでよい)。
<注意>指をけがしないように注意する(力まかせに磨かない)。不安な場合は軍手を着用するとよい。
実験方法5
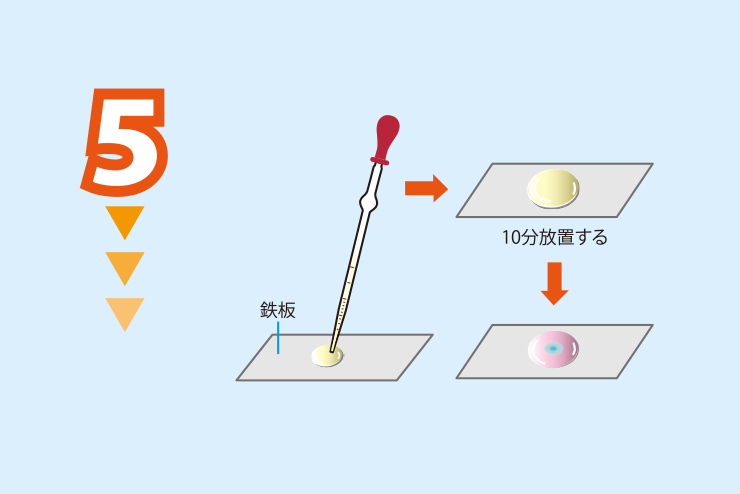
実験方法4の鉄板の表面に実験方法3の水溶液を数滴静かに滴下して10分ほど放置する(この間の変化を観察する)。
<注意1>実験方法3の水溶液が鉄板のふちからこぼれないように,滴下する水溶液の量に注意する。
<注意2>実験後の廃液には金属が含まれるので,先生の指示にしたがって適切に処理すること。
実験の解説
鉄板上にヘキサシアニド鉄(III)酸カリウム水溶液とフェノールフタレイン溶液を加えた食塩水を滴下すると,滴下した水溶液の中心付近が青色に,水溶液の周囲が赤色に変化します。このとき,鉄板上では次の2つの反応が起こっています。
Fe → Fe2+ + 2e– …(1)
O2 + 2H2O + 4e– → 4OH– …(2)
水溶液の中心付近では(1)のように鉄が溶け出し,Fe2+が生じます。このFe2+がヘキサシアニド鉄(III)酸イオンと反応することで,水溶液の中心付近が青色に変化します。また,水溶液の周囲ではでんしe-と空気中の酸素が(2)のように反応します。鉄板を真上から観察すると青と赤の2色からなる瞳のように見えます。
鉄の酸化のしくみを初めて明らかにしたのはイギリスの化学者エバンス(1889〜1980)で,この実験は「エバンスの実験」として知られています。鉄は空気中の酸素だけではなかなか酸化されませんが,水を含むとゆっくり酸化され,電解質を含むと速く酸化されるようになります。海のそばで錆びた鉄製品を見たことがあるかもしれませんね。なお,鉄板の表面を紙やすりで磨くのは,鉄板の表面にできた酸化物を取り除くためです。
化学だいすきクラブニュースレター第56号(2024年4月1日発行)より編集/転載




